- 再生治療
iPS細胞の作り方を現役医師が解説|問題点もあわせて紹介

「iPS細胞はどうやって作られるの?」
「iPS細胞ってどんな遺伝子?」
再生医療や創薬の分野で注目されるiPS細胞ですが、その仕組みを正確に理解している人は多くありません。文献や資料には多くの専門用語や細胞関連因子が並び、内容が難解に感じられることも少なくないでしょう。
しかし、iPS細胞がどのように作られ、どんな課題を抱えているのかを理解することは、これからの医療の可能性を考えるうえで非常に重要です。iPS細胞の基礎を正しく知ることが、再生医療の未来をより身近に感じる第一歩となるでしょう。
本記事では、現役医師がiPS細胞の作り方をわかりやすく解説します。また、問題点もあわせて紹介し、記事の最後には、iPS細胞の作り方に関するよくある質問をまとめていますので、ぜひ最後までご覧ください。
当院「リペアセルクリニック」の公式LINEでは、再生医療の情報提供と簡易オンライン診断を実施しております。
再生医療を用いた治療について気になる方は、ぜひ一度公式LINEにご登録ください。
iPS細胞とは
iPS細胞(人工多能性幹細胞)は、皮膚や血液などの体細胞に特定の遺伝子(山中4因子:Oct3/4、Sox2、Klf4、c-Myc)を導入し、さまざまな細胞へ変化できる能力を取り戻した細胞です。
2006年に山中伸弥教授が開発し、翌年ヒトでの作製にも成功しました。iPS細胞は、患者自身の細胞から作製できるため、倫理的課題や拒絶反応のリスクを低減しつつ、再生医療や創薬、病態研究への応用が期待されています。
一方で、がん化の可能性や安全性の長期的検証、コストなどの課題も残されており、臨床応用に向けた研究が続けられています。
以下の記事では、iPS細胞について詳しく解説しています。
【関連記事】
【医師監修】ES細胞とiPS細胞の違いとは?共通点や課題をわかりやすく解説
iPS細胞を作る際に導入される4つの遺伝子(山中4因子)とは
| 因子名 | 読み方 | 主な役割 |
|---|---|---|
| Oct3/4 | オクトスリー・フォー | 多能性を保つ中心的スイッチ |
| Sox2 | ソックスツー | 細胞を初期状態に戻す働き |
| Klf4 | ケーエルエフフォー | 細胞の増殖と分化を整える調整役 |
| c-Myc | シーマイック | 細胞分裂を促す効率化因子(腫瘍化リスクあり) |
(文献1)
iPS細胞の作製には、Oct3/4、Sox2、Klf4、c-Mycの4つの転写因子(山中4因子)が用いられます。これらは成熟した体細胞を多能性状態へと初期化する役割を果たします。
2006年に京都大学の山中伸弥教授がこの手法を開発し、再生医療に新たな道を開きました。
当初はウイルスによる遺伝子導入が行われていましたが、がん化リスクのあるc-Mycを除外する方法や、プラスミドDNA、mRNA、化合物を用いた非ウイルス性導入法など、安全性を高める改良が進められています。
リプログラミング(細胞の初期化)の仕組み
| 項目 | 内容 |
|---|---|
| 遺伝子のスイッチ操作 | 特定の遺伝子を働かせて細胞の運命を切り替える仕組み |
| クロマチン構造の変化 | 遺伝子を包む構造を開き、活動しやすくする過程 |
| エピジェネティック標識のリセット | DNAの記憶情報を消して細胞を初期状態に戻す働き |
| 細胞の若返り・変換 | 成熟した細胞を多能性細胞や別の細胞へ変える現象 |
(文献2)
リプログラミングとは、体細胞に特定の遺伝子を導入し、分化状態を解除して多能性を回復させる過程です。
導入遺伝子の作用により、分化を維持する遺伝子群の発現が抑制される一方、多能性に関与する遺伝子群の発現が再び誘導されます。その結果、細胞は分化した表現型を失い、多系統への分化能を獲得します。
この現象が実現するためには、転写因子による遺伝子発現の制御やクロマチン構造の再編成、さらにDNAメチル化やヒストン修飾などのエピジェネティック情報(遺伝子のON・OFFスイッチ)のリセットといった、多層的な分子機構が統合的に機能することが欠かせません。
現在も、リプログラミングの効率性や再現性の向上を目指した研究開発が継続されています。
リプログラミングの種類
| 種類 | 詳細 |
|---|---|
| ウイルスベクターによるリプログラミング | ウイルスを利用して遺伝子を細胞内に導入し、多能性を誘導する方法。効率は高いが、ゲノムに組み込まれるリスクを伴う手法 |
| プラスミドやエピソーマルベクターを使ったリプログラミング | ウイルスを使わず、環状DNA(プラスミド)や自己複製型ベクター(エピソーマルベクター)を利用する方法。比較的リスクの低い非ウイルス性導入法 |
| mRNAリプログラミング | 必要な遺伝子情報をmRNAとして一時的に細胞へ導入する方法。ゲノムに影響を与えず、高い安定性をもつ技術 |
| 化合物(低分子化合物)によるリプログラミング | 遺伝子導入の代わりに特定の化合物を用いて細胞の状態を変化させる方法。操作が簡便でコストを抑えられる手法 |
| ダイレクトリプログラミング | 一度多能性を経ずに、ある細胞を別の種類の細胞へ直接変換する方法。再生医療への迅速な応用が期待される技術 |
リプログラミングの主な手法として、ウイルスベクターによる遺伝子導入法、プラスミドやエピソーマルベクターを用いた非ウイルス法、mRNAによる一過性導入法、低分子化合物による誘導法、および多能性を経由せず直接目的細胞へ転換するダイレクトリプログラミングが挙げられます。
その中でも、mRNAや低分子化合物による方法はゲノム改変を伴わないため、遺伝子挿入に関連するリスクが低く、再生医療への応用が期待されています。
ウイルスベクターによるリプログラミング
| 項目 | 内容 |
|---|---|
| 高効率 | ウイルスが細胞に感染しやすく、遺伝子を効率的に導入できる特徴 |
| ゲノムへの組み込み | 遺伝子が長期間働く一方で、ゲノム損傷や腫瘍化のリスクを伴う特性 |
| リスク面に対する工夫 | 病原性を抑えた改変ウイルスや、ゲノムに組み込まれない新しい方法の開発 |
| 取り扱い上の注意 | 効率は高いが、リスクを考慮し慎重な管理が求められる手法 |
| 臨床応用での位置づけ | 研究用としては有用だが、ゲノム挿入リスクのため臨床応用には不向きとされ、現在は非ウイルス的手法が主流 |
(文献3)
ウイルスベクター法は、ウイルスの感染力を利用して遺伝子を効率的に導入できる手法であり、iPS細胞研究の発展に大きく貢献してきました。しかし、導入遺伝子がゲノムに組み込まれるため、遺伝子損傷や腫瘍化のリスクが懸念されます。
そのため研究用途では有用ですが、臨床応用には適していません。現在は、プラスミドやエピソーマルベクター、mRNA、タンパク質導入など、ゲノムへの影響が少ない非ウイルス的手法が主流となっています。
プラスミドやエピソーマルベクターを使ったリプログラミング
| 項目 | 内容 |
|---|---|
| プラスミドベクター | 大腸菌などで増やせる環状DNAを利用し、染色体に組み込まず一時的に遺伝子を働かせる方法。ゲノムへの影響が少ない反面、発現が長続きしにくい特徴 |
| エピソーマルベクター | 細胞内で自律的に複製できるDNAを利用し、比較的安定して遺伝子を発現させる方法。染色体に組み込まれないため、ゲノムへの影響が少ない手法 |
| 特徴と課題 | ゲノム改変のリスクが少ないが、遺伝子発現の持続性や作製効率が課題。再生医療の安全性向上に貢献する技術 |
(文献4)
プラスミドやエピソーマルベクターを使う方法は、ウイルスを利用せずに遺伝子を導入する非ウイルス的手法です。
ゲノムを改変しないため影響が少なく、再生医療の分野で注目されています。一方で、効率や安定性の点で改良の余地があり、研究が進められています。
mRNAリプログラミング
| 項目 | 内容 |
|---|---|
| 方法の特徴 | mRNAを利用して、細胞に必要なタンパク質を一時的に作らせる手法 |
| 仕組み | mRNAが核に入らず、リプログラミング因子を合成して細胞を多能性細胞に戻す働き |
| メリット | 遺伝子が組み込まれないため、ゲノムへの影響が少ない方法 |
| 課題 | mRNAが短時間で分解されるため、複数回の導入が必要となる点 |
| 応用の展望 | mRNA修飾技術の進歩による導入効率の向上と、再生医療への応用拡大の期待 |
(文献5)
mRNAリプログラミングは、合成mRNAを細胞に導入し、山中4因子などのリプログラミング因子を一時的に発現させて多能性を誘導する手法です。
DNAを介さずタンパク質を産生させるため、ゲノムへの影響が少なく、遺伝子変異リスクを抑えられる点が特徴です。
一方で、mRNAは分解されやすく複数回の導入が必要となりますが、臨床応用に適した特性を持つため、再生医療分野で注目されています。
化合物(低分子化合物)によるリプログラミング
| 項目 | 内容 |
|---|---|
| 方法の特徴 | 低分子化合物を用いて、細胞の遺伝子発現や代謝を変化させ、初期化を誘導する手法 |
| 安定性 | 遺伝子をゲノムに組み込まないため、がん化リスクが少ない方法 |
| 仕組み | 細胞内のシグナル伝達経路やエピジェネティック修飾に作用して状態を変える仕組み |
| 応用 | 細胞の若返りや他の細胞への直接変換を可能にする再生医療への応用 |
| 課題 | 効率の低さと再現性の難しさが残る、現在も研究が進められている段階 |
(文献6)
低分子化合物によるリプログラミングは、遺伝子導入を用いず化学物質により細胞の状態を変化させる技術です。細胞内のシグナル経路や転写因子、エピジェネティック制御機構を化合物で調整し、多能性を誘導します。
遺伝子操作を伴わないため、腫瘍化や免疫反応のリスクが低く、コスト面でも優位性があります。一方で、完全な多能性の再現やヒト細胞での安定的な作製には課題が残り、実用化に向けた研究が進められています。
ダイレクトリプログラミング
| 項目 | 内容 |
|---|---|
| 方法の特徴 | 特定の転写因子を導入し、細胞の性質を直接変える手法 |
| 仕組み | 細胞の運命を決める遺伝子スイッチを操作し、他の細胞へ直接変換する仕組み |
| エピジェネティック変化 | 遺伝子に付く化学的標識を調整し、細胞の状態を切り替える過程 |
| 応用 | 線維芽細胞を心筋細胞や肝細胞へ変換し、臓器修復や再生医療に活用する技術 |
| 特徴 | 幹細胞を経ずに目的の細胞を作り出す迅速な変換法 |
(文献7)
ダイレクトリプログラミングは、体細胞を多能性幹細胞に戻すことなく、直接別の細胞種へ転換する技術です。
たとえば、線維芽細胞を神経細胞へ変換するなど、従来の方法に比べて時間と工程を短縮できる点が特徴です。
一方で、転換効率や細胞の機能的安定性には課題が残っており、再現性の向上に向けた改良が進められています。将来的には、組織修復や個別化医療への応用が期待されています。
iPS細胞の作り方と手順
| 作り方と手順 | 詳細 |
|---|---|
| 手順1|体細胞の採取と培養準備 | 皮膚や血液などから体細胞を採取し、増殖しやすい環境で培養を整える工程 |
| 手順2|リプログラミング因子(山中4因子)の準備 | 多能性を誘導するための4つの遺伝子(Oct3/4、Sox2、Klf4、c-Myc)を準備する過程 |
| 手順3|リプログラミング因子(山中4因子)の細胞への導入 | ウイルスやプラスミド、mRNAなどの方法で因子を細胞内に導入し、初期化を促す作業 |
| 手順4|iPS細胞の選別と確立 | 初期化が成功した細胞を選び出し、安定して増殖できるiPS細胞株を確立する段階 |
| 手順5|分化誘導・培養 | iPS細胞を心筋や神経など目的の細胞へ誘導し、機能を持つ細胞として培養する工程 |
| 手順6|品質評価と保存 | 遺伝子や形態、機能を確認し、基準を満たしたiPS細胞を長期保存する過程 |
iPS細胞の作製は、体細胞の採取から品質評価まで複数の段階を経て慎重に進行するプロセスです。まず皮膚や血液などから細胞を採取し、培養後に山中4因子を導入して初期化を誘導します。
得られた細胞の中から多能性を示すものを選別し、安定的に増殖できる株を確立します。
その後、心筋や神経など目的の細胞へ分化を誘導し、機能や遺伝子の状態を確認した上で保存されますが、各工程は精密な管理を要し、条件次第で効率が大きく変わる複雑な過程です。
手順1|体細胞の採取と培養準備
| 項目 | 詳細 |
|---|---|
| 採取する細胞の種類 | 皮膚線維芽細胞、末梢血単核球、尿由来細胞、口腔粘膜細胞など、iPS細胞作製に利用される体細胞 |
| 採取方法 | 皮膚生検や採血など、身体への負担が少ない採取法 |
| 培養環境の管理 | クリーンベンチ下での無菌操作と感染防止の徹底 |
| 培養条件の安定化 | 専用培地を使用し、細胞の健康維持と増殖促進を図る環境整備 |
| 細胞状態の確認 | 顕微鏡による形態観察と、ストレスや老化の有無の評価 |
| リプログラミング準備 | 分裂周期や培養密度を整え、遺伝子導入効率を高める工程 |
| 品質とリスク面の確認 | 染色体異常、遺伝子損傷、細菌・マイコプラズマ汚染の有無を検査する品質管理 |
iPS細胞の作製は、患者やドナーから皮膚線維芽細胞や血液中の単核球などを低侵襲な方法で採取し、培養することから始まります。
採取された細胞は無菌環境下で培養され、栄養素や成長因子を含む専用培地で維持されます。この際、温度やpHなどの培養条件を厳密に管理し、増殖能の高い良質な細胞の確保が重要です。
採取および培養段階の品質管理は、その後のリプログラミング効率や細胞の品質に直結するため、重要な工程です。
手順2|リプログラミング因子(山中4因子)の準備
| 項目 | 内容 |
|---|---|
| 遺伝子導入の準備 | 山中4因子を導入するために、研究目的やリスク面に対する配慮に応じて導入ベクターを選択する工程 |
| ウイルスベクター法 | 初期化効率が高く研究で広く使用される方法。ゲノムに組み込まれるため臨床応用には不向きな手法 |
| エピソーマルベクター法(非ウイルス法) | ゲノムに組み込まれないDNAを利用する方法。リスクが低く臨床用iPS細胞の作製に用いられる手法 |
| mRNA法・タンパク質導入法 | DNAを使わず、一時的に初期化因子を発現させる方法。腫瘍化リスクが低い技術 |
| 補助因子・化合物の利用 | Glis1やValproic Acid、L-Mycなどを併用して、リプログラミング効率や安定性を高める工夫 |
| 観察・評価 | 形態変化、分裂速度、コロニー形成、染色体の安定性などを観察する工程 |
(文献1)
リプログラミング(細胞初期化)は、分化した体細胞に特定の転写因子を導入し、分化状態を解除して多能性を獲得させる工程です。
中心となるのが、山中4因子(Oct3/4、Sox2、Klf4、c-Myc)であり、これらが協調的に遺伝子発現パターンを再構築することでiPS細胞が樹立されます。
Oct3/4は多能性維持、Sox2は初期化促進、Klf4は細胞安定化、c-Mycは効率向上をそれぞれ担います。
導入法にはウイルスベクター法、非ウイルス法、mRNA法などがあり、近年は代替因子や低分子化合物の併用による改良が日々進んでいる状況です。
手順3|リプログラミング因子(山中4因子)の細胞への導入
| 項目 | 詳細 |
|---|---|
| 導入方法の概要 | 細胞に山中4因子を導入し、初期化を促して多能性を引き出す工程 |
| 導入操作の流れ | 細胞の状態を整え、ベクター導入から回復培養までを行う一連の工程 |
| プレコンディショニング | 細胞の分裂活性を高め、遺伝子導入効率を上げるための前処理 |
| ベクター導入手法 | ウイルス感染、エレクトロポレーション、リポフェクションなどで遺伝子を導入する操作 |
| 回復培養 | 導入後の細胞ストレスを軽減し、生存率を高めるための培養調整 |
| 初期化の観察 | 細胞の形態変化やコロニー形成を顕微鏡下で観察する工程 |
| 形態変化の特徴 | 扁平な形から丸みを帯びた細胞へ変化し、幹細胞様のドーム状コロニーを形成する特徴 |
(文献8)
リプログラミング因子の導入は、体細胞をiPS細胞へ初期化する中核工程です。レトロウイルスやレンチウイルスを用いる方法は効率が高い一方、ゲノムへの遺伝子組込みによる変異リスクが懸念されます。
そのため、プラスミドDNAやmRNA、低分子化合物を利用した非ウイルス法が主流です。導入後、細胞は数日から数週間かけて形態変化し、未分化状態へ移行します。
この過程では、細胞密度・培地組成・温度・pH・酸素濃度の厳密な管理が必要です。操作はバイオセーフティレベル2以上の環境下で実施されます。(文献9)
手順4|iPS細胞の選別と確立
| 項目 | 内容 |
|---|---|
| 工程の概要 | リプログラミング後に得られた細胞群から、多能性を持つ細胞を選び出し、安定した株を確立する工程 |
| 選別方法 | 顕微鏡による形態観察や、多能性マーカー(Nanog、SSEA-4など)の発現確認による選別 |
| 確立されたiPS細胞の特徴 | 長期間の自己増殖が可能で、分化誘導にも適した安定した性質を持つ細胞 |
| 品質管理の重要性 | 品質が不十分な株は研究や臨床応用に支障をきたすため、厳密な評価が必要な段階 |
(文献10)
リプログラミング後に形成された細胞コロニーの中から、多能性を獲得したものを顕微鏡観察とOct4やNanogなどのマーカー検査で同定します。
選別されたコロニーは再培養され、FGF2を含む培地と低酸素条件(約5% O₂)で未分化状態を維持します。(文献11)
その後、分化試験や染色体解析により品質を確認し、樹立されたiPS細胞株を液体窒素下(–196℃)で凍結保存した後、複数のクローンを比較検証し、もっとも品質の高い株をマスターセルバンクとして登録するのが一連の流れです。(文献12)
手順5|分化誘導・培養
| 項目 | 内容 |
|---|---|
| 工程の概要 | 確立したiPS細胞を神経、心筋、膵β細胞など目的の細胞へ誘導する工程 |
| 誘導の方法 | 成長因子や化合物を加え、発生過程を再現するように環境を整える操作 |
| 条件の調整 | 細胞の種類に応じて培地成分や誘導のタイミングを適切に調整する過程 |
| 分化後の利用 | 疾患モデル、薬剤評価、再生医療研究などへの応用 |
| 重要性 | 誘導の精度と再現性が研究および臨床応用の信頼性を支える要素 |
樹立されたiPS細胞は、神経・心筋・肝臓・網膜など目的の細胞へ分化誘導されることで、臨床応用が可能となります。
分化誘導とは、発生過程を模倣してiPS細胞に特定の分化経路をたどらせる操作です。WntやFGFなどのシグナル伝達経路を人工的に制御して行われます。
誘導は段階的に実施され、初期は低酸素条件(5% O₂)で未分化性が維持され、成熟期には通常酸素濃度(20% O₂)下で機能的成熟が促されます。この過程では、2〜3日ごとに培地交換を行い、細胞状態を維持します。(文献15)
得られた細胞は、遺伝子発現解析、免疫染色、機能試験により評価され、目的細胞としての性質と機能を確認することで、再生医療や創薬研究への応用が可能です。
手順6|品質評価と保存
| 項目 | 内容 |
|---|---|
| 品質評価の目的 | 信頼できるiPS細胞の確認 |
| 多能性の確認 | 三胚葉(外胚葉・中胚葉・内胚葉)への分化能の確認 |
| マーカー検査 | iPS細胞の特徴を示すたんぱく質(Oct4、Sox2、Nanog、TRA-1-60など)の発現確認 |
| ゲノム・染色体検査 | 遺伝子や染色体に異常がないかの確認 |
| エピジェネティック評価 | DNAやヒストンの状態、細胞形態の観察 |
| 培養履歴の管理 | 使用した培地、継代回数、作業記録の保存による履歴管理 |
| 凍結保存の手順 | 細胞の状態を整え、専用液でゆっくり冷やして液体窒素で保存 |
| 細胞バンク管理 | マスター株とワーキング株を分けて保管する二段階体制の維持 |
| 長期安定性の確認 | 定期的な遺伝子検査と凍結・解凍による変化の確認 |
| 倫理・法規制の遵守 | 幹細胞利用基準に沿った管理運用 |
樹立されたiPS細胞は、品質評価と長期保存の工程を経ます。評価では、染色体異常の有無、分化能、増殖性、腫瘍化リスクなどを確認し、臨床応用に適した品質を保証します。
基準を満たした細胞は液体窒素下で凍結保存され、細胞バンクとして管理されます。この工程は、厳格な判定により異常細胞を除外し、iPS細胞を実用可能な形で確立する最終段階です。
iPS細胞を作る際の問題点
| 問題点 | 詳細 |
|---|---|
| 技術的な問題点(効率・品質・腫瘍化リスク) | iPS細胞ができる割合の低さ、細胞ごとの品質の違い、遺伝子操作による腫瘍発生の可能性 |
| 臨床応用における問題点(免疫・実用化) | 移植後の免疫拒絶反応のリスク、大量生産や品質維持の難しさ |
| 倫理・法規制上の課題 | 遺伝子操作への社会的理解の不足、法規制に沿った管理体制の必要性 |
iPS細胞の研究は大きく進展していますが、実用化には多くの課題が残されています。作製効率や品質のばらつき、腫瘍化リスク、免疫反応、倫理的問題などが代表的な課題です。
とくに臨床応用では、高品質な細胞の安定的な供給が不可欠です。さらに、研究や治療に要する高コスト、厳格な法的規制の遵守も実用化への障壁となっています。
技術的な問題点(効率・品質・腫瘍化リスク)
| 問題点 | 詳細 |
|---|---|
| 効率の問題 | 細胞の初期化成功率の低さ、細胞の種類や方法による差の存在 |
| 品質のばらつき | 作製条件が同じでも性質や分化能力に違いが生じる不安定性 |
| 腫瘍化リスク | 遺伝子導入によるDNA損傷や未分化細胞残存による腫瘍形成の可能性 |
iPS細胞作製における技術的課題には、作製効率の低さ、品質のばらつき、腫瘍化リスクがあります。作製効率が低いため、多くの細胞が初期化過程で失われます。
また、同一条件下でも細胞の性質に差が生じることがあり、品質の安定化も課題です。さらに、遺伝子操作に伴う腫瘍化リスクが懸念されており、リスクを低減する手法の改良や未分化細胞の除去技術の開発が進められています。
臨床応用における問題点(免疫・実用化)
iPS細胞の臨床応用には、免疫反応と実用化に関する課題が残されています。患者自身の細胞から作製した場合は免疫拒絶の可能性が低いものの、他人の細胞(他家iPS細胞)を用いる場合には拒絶反応が起こる恐れがあります。
HLA型を一致させた細胞バンクの整備や免疫抑制剤の使用に加え、製造コスト、安全性の検証、未分化細胞の除去、倫理・法規制への対応などが、実用化に向けた重要な課題です。
倫理・法規制上の課題
| 問題点 | 詳細 |
|---|---|
| 同意と個人情報の保護 | 細胞提供者の同意取得とプライバシー保護の徹底 |
| 生殖細胞・胚研究の制限 | iPS細胞から生殖細胞を作る研究に対する法律上の制約 |
| キメラ研究の倫理問題 | ヒトと動物の細胞を混ぜる研究に伴う倫理的配慮の必要性 |
| 法的規制と審査体制 | 再生医療安全法や薬機法による厳格な審査と管理体制 |
| 実施基準と許可制度 | 再生医療の実施に必要な計画届出、施設基準、許可制度の遵守 |
| 社会的信頼と法改正への対応 | 新たな規制や指針の改定に合わせた継続的な対応の必要性 |
iPS細胞の臨床応用には、倫理的配慮と法的規制の遵守が不可欠です。細胞提供者の権利保護のためのインフォームドコンセントや個人情報保護、生殖細胞研究やキメラ作成に関する倫理基準の遵守が求められます。
さらに、再生医療安全法や薬機法に基づく厳格な審査・許可制度により、品質管理と社会的信頼の維持が図られています。
iPS細胞の作り方に関する研究と課題の両面を知っておこう
iPS細胞は再生医療の可能性を大きく広げる技術ですが、依然として発展途上にあります。作製効率の改善、腫瘍化リスクの低減、分化誘導の安定化など、解決すべき課題は少なくありません。
しかし、これらの研究の進展により、新たな治療法や創薬の実現が近づきつつあります。今後は、研究者・医療従事者・社会が連携し、倫理的かつ実践的に取り組むことが、技術の進歩と適切な医療応用に不可欠です。
再生医療を用いた治療を検討されている方は、当院「リペアセルクリニック」へご相談ください。当院では、再生医療を応用した治療を提供しています。
再生医療は、損傷した組織や臓器の機能を、生体の再生能力により回復させる治療法です。自然治癒力を活用して血管・神経・軟骨などの修復を促し、根本的な機能回復を目指します。薬物療法や外科的治療では対応が困難な疾患に対する新たな選択肢として期待されています。
ご質問やご相談は、「メール」もしくは「オンラインカウンセリング」で受け付けておりますので、お気軽にお申し付けください。
\無料オンライン診断実施中!/
iPS細胞の作り方に関するよくある質問
iPS細胞を作る研究はどこで行われていますか?
iPS細胞の研究は、主に大学や公的研究機関で進められています。代表的な機関として以下が挙げられます。
| 研究機関 | 詳細 |
|---|---|
| 京都大学 iPS細胞研究所(CiRA) | 山中伸弥教授が設立し、iPS細胞研究の世界的拠点として基礎から臨床応用までを推進 |
| 理化学研究所(RIKEN) | iPS細胞を使った疾患の再現研究や再生医療の実用化研究の推進 |
| 東京大学・大阪大学・慶應義塾大学など | 心筋・神経・網膜など専門分野に応じた応用研究の実施 |
| 海外研究機関(ハーバード大学・スタンフォード大学・ケンブリッジ大学など) | 国際的な共同研究によるiPS細胞技術の発展 |
iPS細胞研究は、京都大学CiRAを中心に、国内外の大学や研究機関で幅広く進められています。
iPS細胞は一般的な医療機関でも作れますか?
iPS細胞の作製は一般の医療機関では実施できません。製造には高度な技術と設備が必要であり、GMP(医薬品製造管理・品質管理基準)に準拠した専用の細胞加工施設でのみ行われます。
京都大学iPS細胞研究財団などの専門機関で臨床グレードのiPS細胞が製造され、医療機関は必要に応じてそれらの提供を受けて利用します。(文献20)
iPS細胞で治せる病気は何ですか?
iPS細胞を用いた治療や研究は、現在さまざまな病気を対象に進められています。代表的な疾患は以下です。
- 筋萎縮性側索硬化症(ALS)
- 脊髄性筋萎縮症
- 進行性骨化性線維異形成症(FOP)
- ペンドレッド症候群
- パーキンソン病
- 加齢黄斑変性症
- 重症心不全
- 血小板減少症
患者由来のiPS細胞を用いて、病気の仕組みの解明や薬剤の効果・副作用の評価(創薬研究)が行われています。希少疾患や難病の治療・研究にも注目が集まっており、複数の疾患で臨床試験が進められています。
以下の記事では、iPS細胞で治癒が期待できる病気について詳しく解説しています。
参考文献
安全なiPS細胞を高効率に作製 転写因子Glis1の導入でiPS細胞の樹立効率が大幅に改善|産総研 TODAY 2011-11
「リプログラミング」がいのちの再生を可能にする。|立命館大学研究活動報 RADIANT
センダイウイルス:ベクター化と先端医療開発への応用|生物材料インデックス
転写因子Glis1により安全なiPS細胞の高効率作製に成功 Nature 6月9日号に掲載|京都大学 iPS細胞研究所 CiRA(サイラ)
細胞間のmRNA移動が多能性幹細胞の運命をリプログラムすることを発見|Institute of SCIENCE TOKYO
Chemical journey of somatic cells to pluripotency|SpringerOpen
ダイレクトリプログラミングによる心血管発生と再生医学への新しい展開|日本小児循環器学会雑誌
Efficient Generation of Human iPS Cells by a Synthetic Self-Replicative RNA|PMC PubMed Central®
【人を対象とする研究】H-6.再生医療の発展と法的規制―再生医療等安全性確保法について|日本医師会 Japan Medical Association
疾患特異的iPS細胞を用いた先天性心疾患の病態解明|日本小児循環器学会雑誌
Human Pluripotent Stem Cell Quality|STEMCELL Technologies
関連する症例紹介
-

“リペア幹細胞” 両膝の痛みが大幅に軽減!痛みのない日常を取り戻す!両変形性ひざ関節症 40代 女性
-
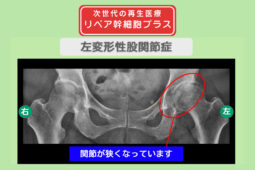
リペア幹細胞プラス【分化誘導】痛み10段階中10が4に!靴下が履ける日常を取り戻した!変形性股関節症 50代 女性
-
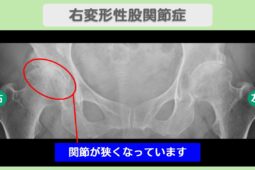
“リペア幹細胞” 痛み10段階中4が2に!手術を回避して日常を取り戻す!右変形性股関節症 70代 女性
-
リペア幹細胞プラス【分化誘導】 痛み10段階中6が1に!テニス復帰も夢じゃない! 両変形性ひざ関節症 60代 女性
-
“リペア幹細胞” 右膝痛み4が0に完全消失!快適な歩行を取り戻した!両膝変形性関節症 70代 女性
-
“リペア幹細胞” 痛み10段階中10が2に!人工関節を回避! 左変形性股関節症 60代女性